藥廠拒獲准疫苗用於臨床試驗比較 CEPI:恐衝擊疫苗開發
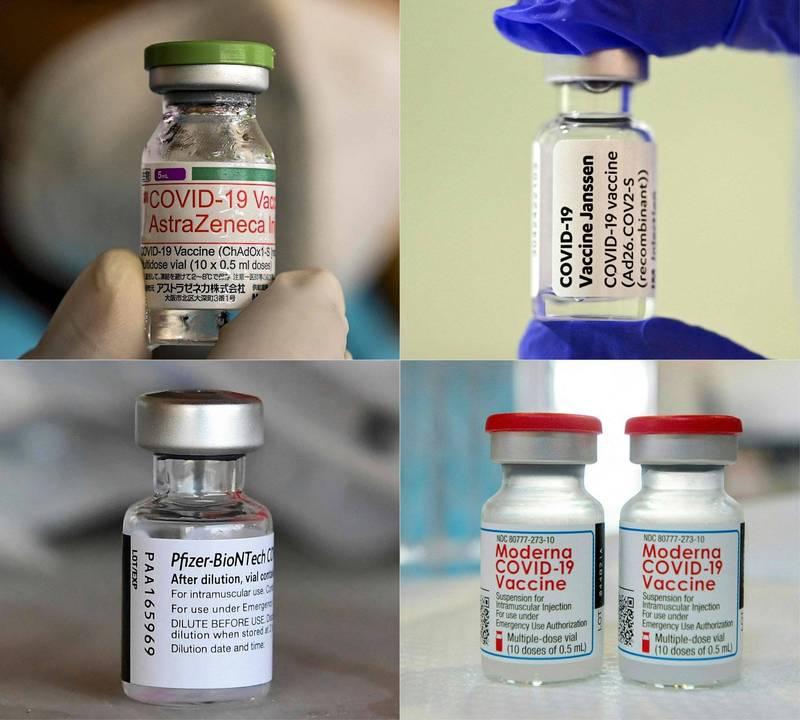
「流行病防範創新聯盟」(CEPI)呼籲,武漢肺炎疫苗製造商應讓旗下獲批准的疫苗用於臨床試驗比較,否則恐阻礙其他新疫苗開發。左上為AZ疫苗、右上嬌生疫苗、左下輝瑞BNT疫苗、右下莫德納疫苗。(法新社合成)
〔中央社〕「流行病防範創新聯盟」(CEPI)今天表示,武漢肺炎(新型冠狀病毒病,COVID-19)疫苗製造商應當讓旗下獲批准疫苗用於臨床試驗比較,否則恐阻礙其他新疫苗開發。
主要的疫苗研究目前在針對COVID-19感染率試驗上,僅以潛在疫苗和安慰劑作比較,但在有效疫苗廣泛可用的國家中,這樣的試驗可能不再被視為合乎倫理。
由多國以及比爾暨梅琳達蓋茲基金會(Bill and Melinda Gates Foundation)資助、2017年成立的流行病防範創新聯盟指出,新疫苗將須與既有疫苗進行比較測試,而非安慰劑對照組。
流行病防範創新聯盟的疫苗研究發展負責人沙維爾(Melanie Saville)發表聲明說:「無法獲得比較疫苗已拖累了具前景候選疫苗的開發,對COVID-19疫苗開發、供應的潛在衝擊相當巨大。」
流行病防範創新聯盟指出,既有疫苗是根據供應合約進行販售,並未預見臨床試驗方面使用。
沙維爾說:「迄今為止,疫苗製造商一直不願改變此安排,恐會導致重要的COVID-19疫苗研發停滯不前。」
但英國阿斯特捷利康(AstraZeneca)藥廠與牛津大學研發的疫苗,已在數種疫苗計畫或正進行的試驗中,被當作比較疫苗,這包含義大利的ReiThera Srl、法國Valneva、台灣高端疫苗生物製劑以及韓國SK生物科學公司(SK Bioscience)。
阿斯特捷利康針對流行病防範創新聯盟的說法回應表示,會「繼續與業界合作和分享資源,以因應疫情」。
其他主要西方國家COVID-19疫苗製造商,如輝瑞(Pfizer)與研發夥伴BioNTech、莫德納(Moderna)和嬌生(Johnson & Johnson),尚未回應置評要求。
流行病防範創新聯盟的美國負責人勞瑞(Nicole Lurie)告訴路透社,販售已獲許可疫苗的公司,無積極意願協助可能導致競爭性產品的開發試驗。
她又說,各國應該與疫苗製造廠商重新協商供應合約,讓疫苗得以用於臨床試驗。騰出數萬劑疫苗供臨床試驗使用,相較於製藥廠交貨的數以億計疫苗仍屬相當少量。
相關新聞請見︰
「武漢肺炎專區」請點此,更多相關訊息,帶您第一手掌握。
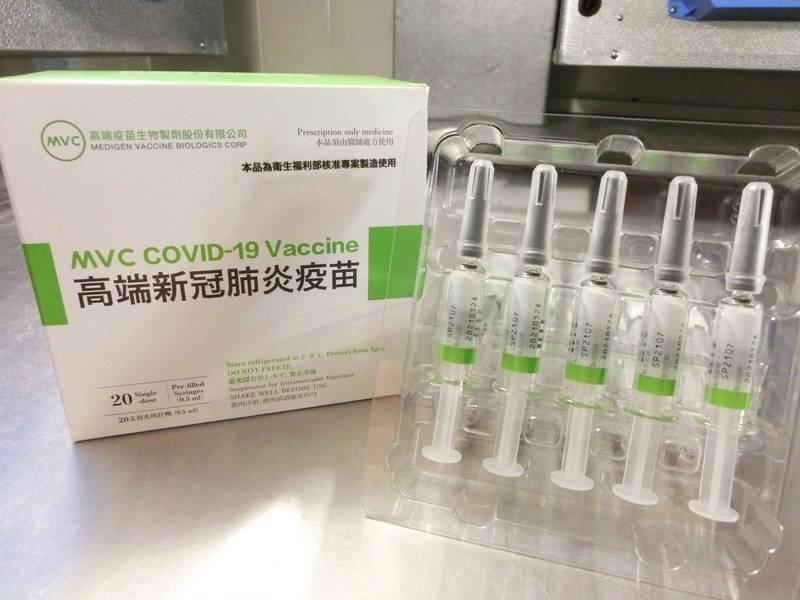
台灣的國產高端武漢肺炎疫苗透過與AZ疫苗比較產生抗體的能力,通過食藥署緊急使用授權。(資料照,食藥署提供)















