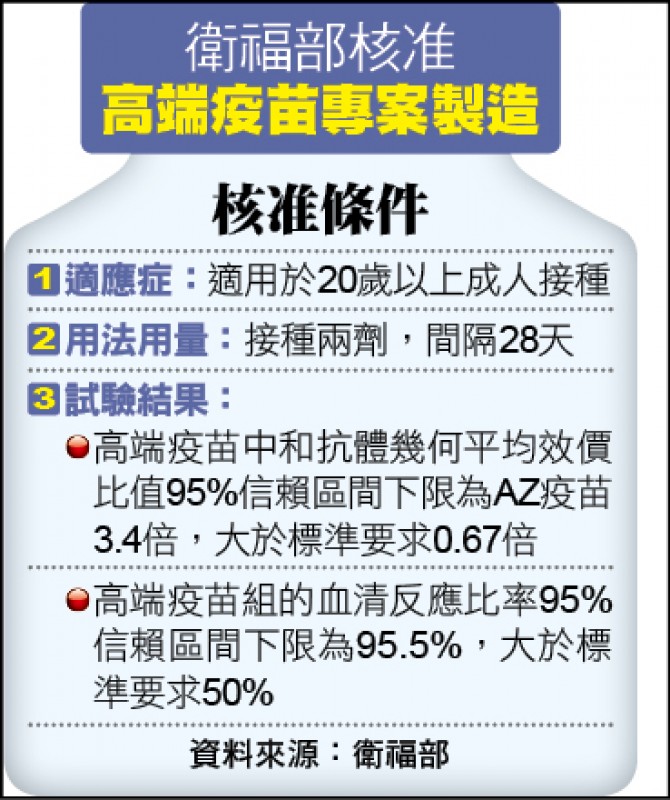
高端疫苗通過EUA 中和抗體效價為AZ的3.4倍/血清反應比率也達95.5% 遠高於50%的標準要求

高端與聯亞COVID-19二期臨床試驗期中分析數據
〔記者邱芷柔、林惠琴/台北報導〕高端疫苗完成緊急使用授權(EUA)審查,通過食藥署核准可專案製造,後續獲ACIP(衛福部預防接種組)審議通過,才能納入公費疫苗。ACIP委員、林口長庚兒童感染科主治醫師黃玉成說,仍會有人認為需要做完三期臨床試驗才能通過,很可能就是審查會議上有專家反對通過的原因,而這只是看法不同,沒有對錯;但多數專家同意通過EUA,應該尊重結論。
針對國產疫苗,食藥署以免疫橋接(immuno-bridging)方式,採用免疫原性(中和抗體)作為疫苗的替代療效指標,也就是對照國人接種AZ疫苗與國產疫苗臨床試驗結果,要求國產疫苗中和抗體效價須不劣於AZ。
今年三月底,食藥署招募兩百名部立桃園醫院的醫護人員接種二劑AZ,二十八天後抽取血清分析。食藥署署長吳秀梅昨宣布高端疫苗通過EUA審查,兩項重要依據包括高端與AZ的原型株活病毒中和抗體幾何平均效價比值 (GMTR),在九十五%信賴區間下限(多次試驗結果的九十五%信心水準之最低值)為三.四倍,遠大於標準要求○.六七倍(也就是至少不可低於三分之二算過關);另高端血清反應比率,也遠大於五十%的標準要求。
陳時中:審查資料未來會公布
食藥署COVID-19疫苗專家會議召集人鍾飲文說明,GMTR標準要求是假設AZ組為一,高端組須達○.六七倍,高端的數據遠高於標準要求。在血清反應比率,要求高端組要有五十%以上出現血清反應,結果高端在九十五%信賴區間下限,有九十五.五%出現血清反應,同樣高於標準要求。
外界關心審議過程、中和抗體相關數據是否公開?指揮官陳時中回應,專家均經過充分討論,未來會公開相關審查資料,至於中和抗體效價的數據,在所有廠商審查完畢前暫不公布。黃玉成說,全世界沒有幾個國家能全程公開審議過程;美國已發展得很成熟,台灣未來若能成熟看待專業審查,當然也可以依循。
聯亞已補件 盼本週完成審查
指揮中心指聯亞疫苗正在積極審查中,中國醫藥大學兒童醫院兒童感染科主任、聯亞疫苗試驗主持人黃高彬表示,外界拿高端與聯亞的中和抗體效價相比,但其實兩者進行實驗的病毒株不同,直接比較不夠客觀。目前聯亞已經完成補件,希望這週或最慢下週前就能完成審查。
疫苗為戰備物資 國產國造有必要
黃玉成及黃高彬都認為,雖國內有各種不同聲音,但應該要尊重專業;疫苗就是戰備物資,有國產國造的必要性,相信穩定供貨就能幫台灣打贏這一仗。
衛福部核准高端疫苗專案製造











